Thème 3 Corps humain et santé
|
Prévalence:Terme de l'épidémiologie; nombre de personnes atteintes d'une certaine
maladie à un moment donné dans une population donnée.

|
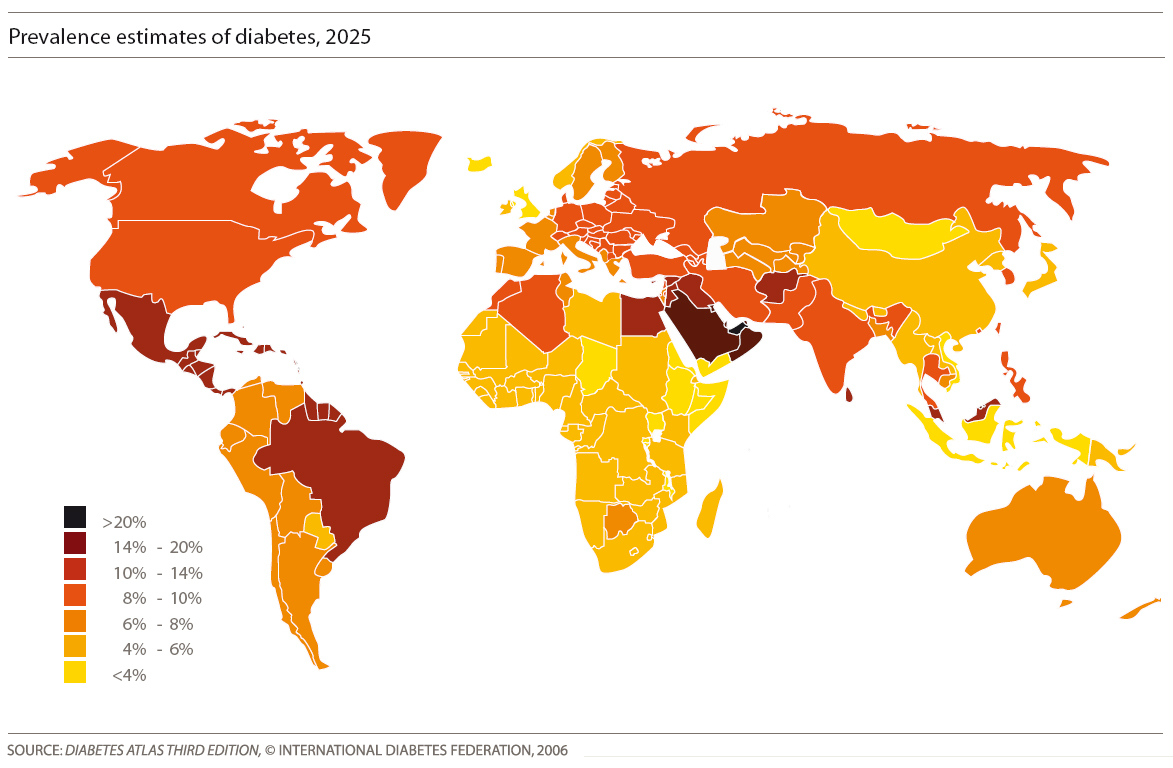
L'objectif de ce thème est de comprendre pourquoi le diabète est une maladie à prendre sérieusement en compte du fait de sa prévalence actuelle
(voir projection de cette prévalence en 2025 carte ci-contre). Cependant, le diabète est une maladie à multiple facettes car différents facteurs interviennent
dans l'apparition de la maladie. Le diabète est lié à une hyperglycémie chronique (excès de glucose dans le sang y compris à jeun). On distinguera deux grands types
de diabète, leurs origines, les prédispositions génétiques, les facteurs favorisant l'apparition du diabète. On montrera aussi comment,
la connaissance des mécanismes de régulation de la glycémie permet de mettre au point des médicaments visant à diminuer la glycémie.
|
Chap.I Les enzymes intervenant dans la digestion des glucides
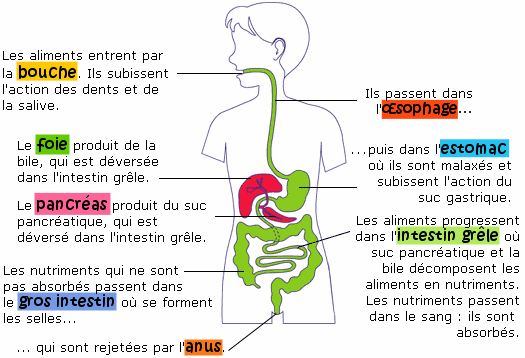 | Ci-contre un rappel sur le rôle de différents organes intervenant dans la digestion.
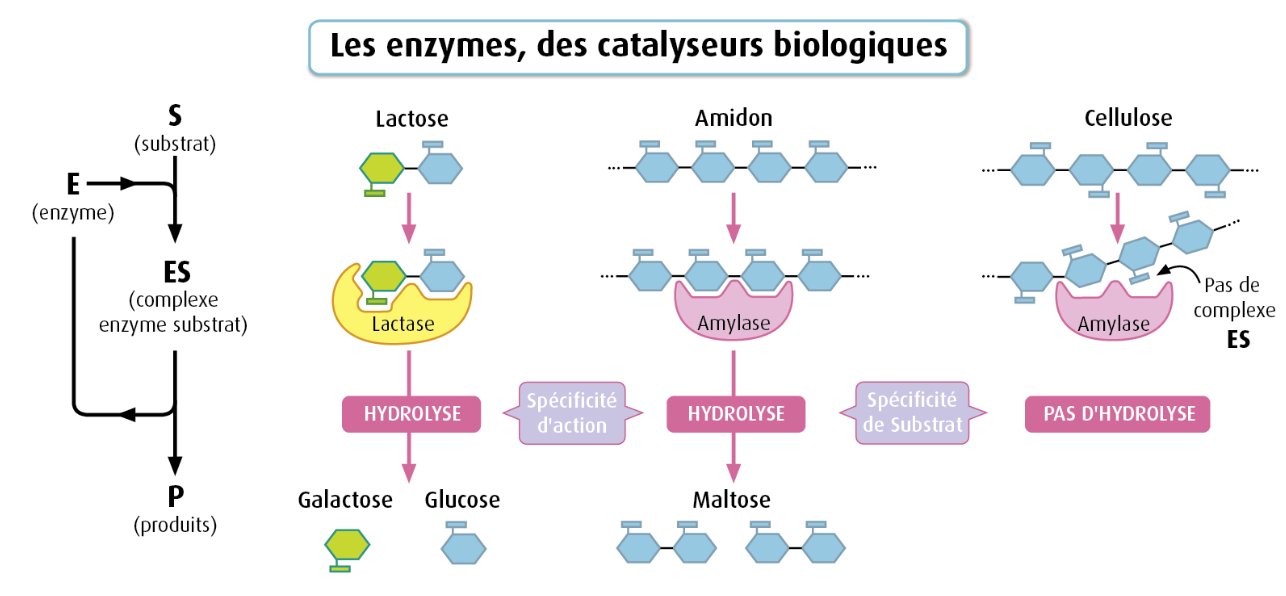
Dans ce chapitre, on s'intéresse en particulier aux enzymes digestives: celles qui permettent une simplification moléculaire des aliments ingérés.
Cette simplifaction correspond à des hydrolyses de molécules oraganiques complexes comme des macromolécules glucidiques (amidon), des protéines, des lipides.
On s'intéressera en particulier aux enzymes intervenant dans la digestion des glucides.
|
I Rôle et spécificité des enzymes
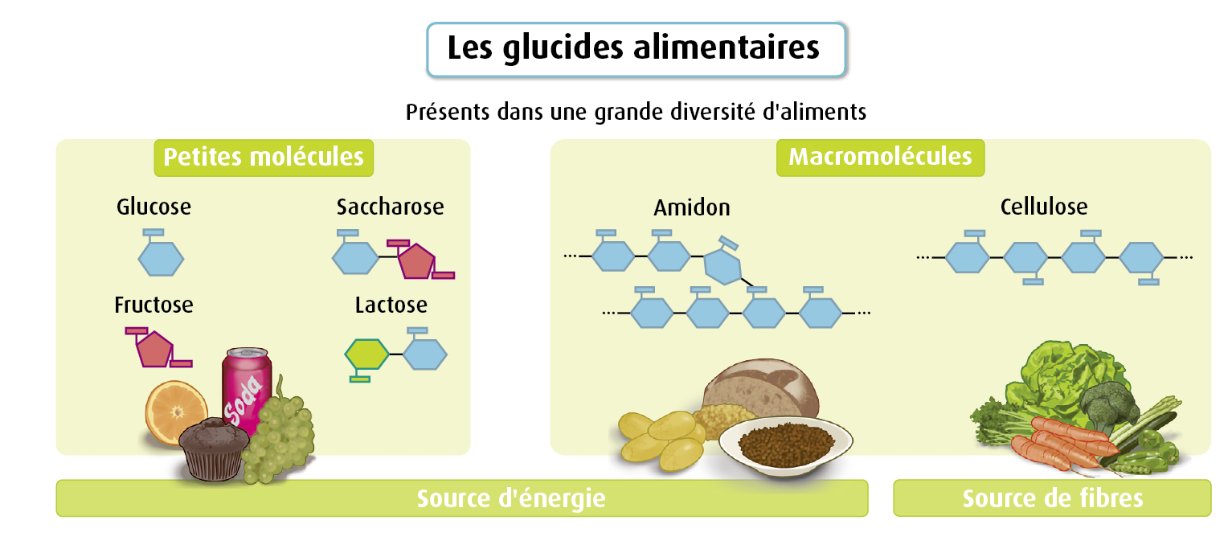
glucose: molécule glucidique simple appelé ose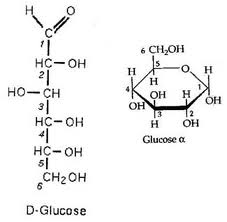 |
Fructose: molécule glucidique simple appelé ose de même fromule brute que le glucose mais de structure différente dans l'espace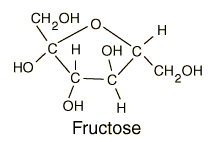 |
saccharose: molécule de formule C12H22O11, elle est composée de deux oses associés par une laison covalente, glucose et fructose. Le saccharose est extrait de la betterave sucrière ou de la canne à sucre.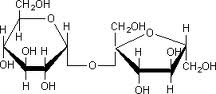 |
amidon: polymère du glucose de formule brute (C6H10O5)n, on le trouve dans les aliments appelés féculents (pâtes, riz, pomme de terre...) 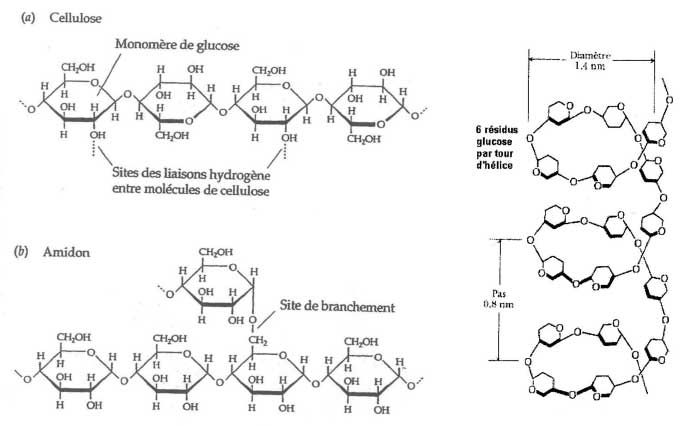 |
Consigne 1: Télécharger le TP n°1 ci-dessous. Elaborer une stratégie de résolution sur votre cahier et garder cette trace écrite (elle servira au TP que vous ferez...plus tard si tout va mieux) et visionner la vidéo à propos de la Liqueur de Fhehling ci-dessous.
|
Consigne 2: Afin de mettre en oeuvre le protocole, réaliser des schémas montrant comment vous feriez en TP. Puis vous passerez à l'étape B du TP en réalisant un tableau des résultats attendus et vous exploiterez ces résultats pour conclure. |
Vous savez que pour mettre en évidence l'amidon, on utilise de l'eau iodée. L'eau iodée a déjà été utilisé lors d'un TP (thème 1 à propos de la synthèse d'amidon). Or, lors de l'hydrolyse de l'amidon, ce dernier est décomposé et donne différentes molécules glucidiques de plus petite taille comme des dextrines, du maltose et du glucose. Dextrine, maltose et glucose sont des sucres dits réducteurs et réagissent positivement avec la liqueur de Fehling. |
II Les conditions d'action des enzymes
Consignes: cliquez sur le lien suivant et suivre les questions. Un document est à télécharger ou à recopier dans votre cahier pour garder une trace de cette activité.S'entraîner à l'analyse de résultats expérimentaux: test d'hydrolyse de l'amidon à différentes températures |
Ci-dessous le TP qui correspond à l'activité que vous venez de faire. Télécharger, imprimer si vous le pouvez et garder la trace de ce TP. Vous pouvez faire la stratégie de résolution pour ce TP.
TP n°2 Aide majeure: protocole détaillé |
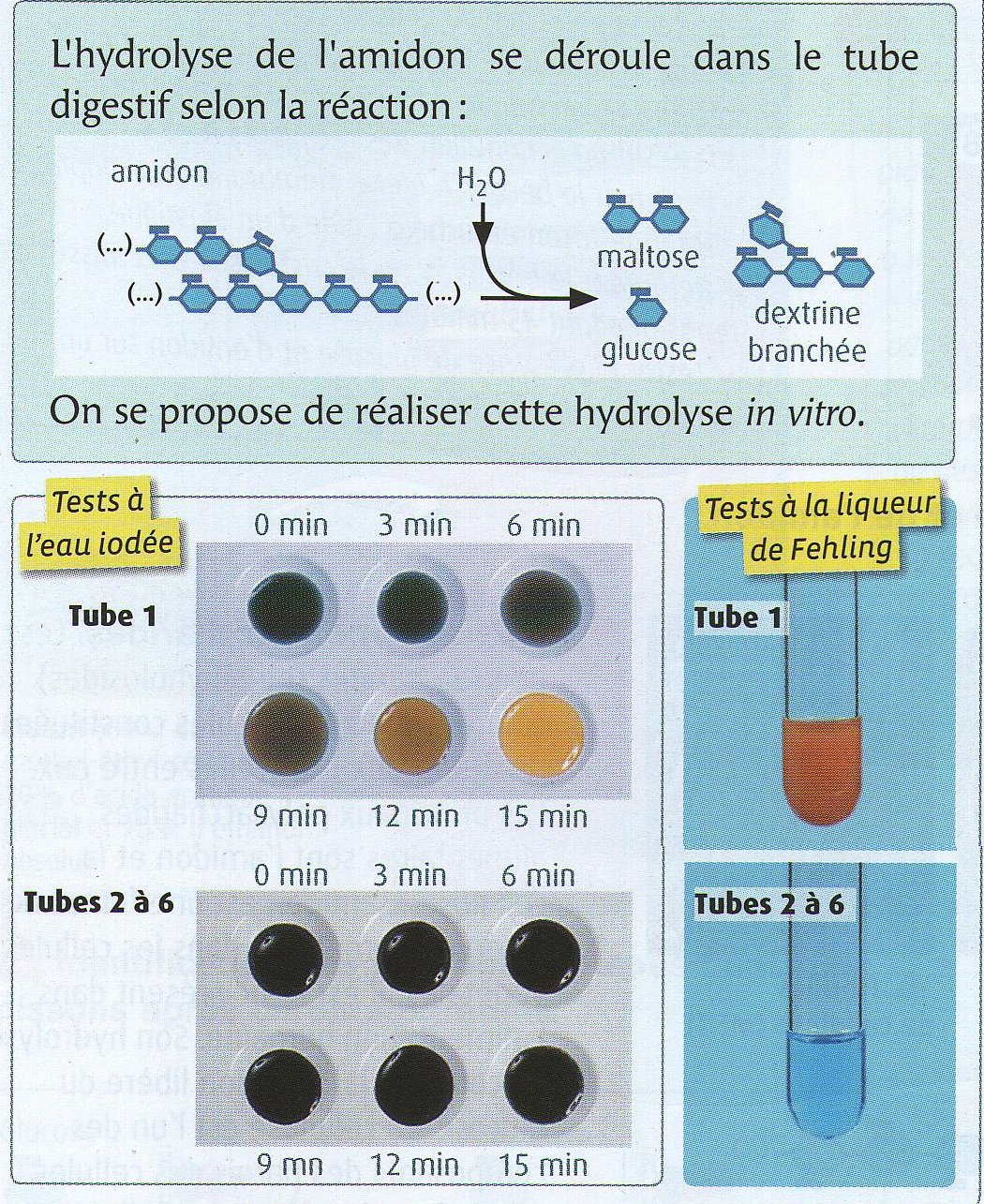 | Des exemples de résultats obtenus à différentes températures. Les tubes 1 à 6 contiennent de
l'amidon et de l'amylase (les concentrations et les quantités sont à chaque fois identiques). La plaque de titration contient deux gouttes d'eau iodée. Seul le tube 1 a été porté
à 37°C. Tube 2: 0°C; tube 3: 7°C; tube 4: 70°C; tube 5: 80°C; tube 6: porté à une température proche de l'ébullition.
|
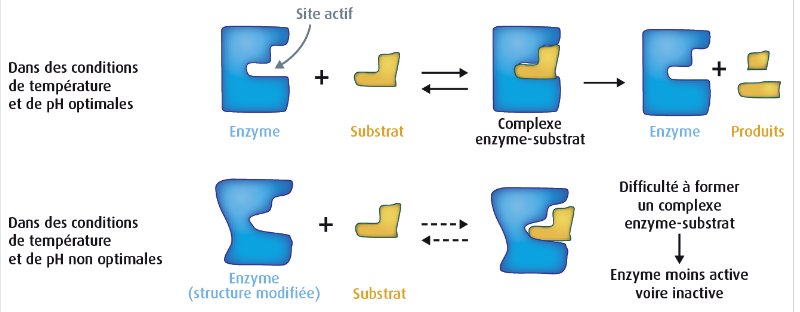
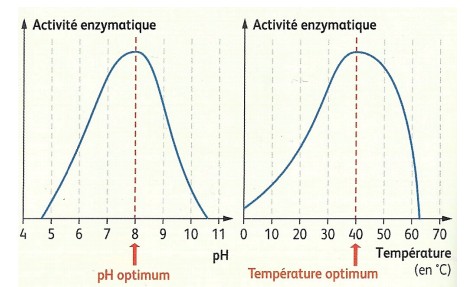 | Sur ces deux graphiques, on observe le résultat de l'activité d'une enzyme testée soit à
différentes températures, soit à différents pH. on canstate ainsi que cette enzyme présente une activité maximale pour une température et un pH dits optimaux,
ici respectivement de 40°C et 8. Ne pas confondre optimum et maximum!
|
III La réaction enzymatique
Consignes: Visionner la vidéo suivante. Commencer à prendre des notes sur votre cahier à partir de la partie "L'activité enzymatique => Comment agit une enzyme?" à 2 min19. |
Consignes: tester vos connaissances à l'aide de l'activité proposée ci-dessous (cliquez sur le lien). A la fin de l'activité, recopier le texte à trou que vous avez complété (la correction est donnée en cas d'erreur!) et souligner les mots clefs.Comment agit une enzyme |
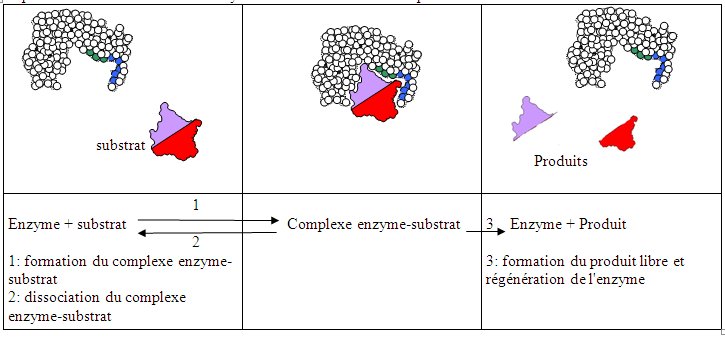 |
Evolution de la vitesse initiale d'une réaction en fonction de la concentration initiale en substrat |
On souhaite connaître la vitesse d'une réaction enzymatique. Pour cela, on peut mesurer la quantité de substrat qui disparaît ou la quantité de produits qui apparaît par exemple en fonction du temps. En faisant simple, on peut alors évaluer une vitesse qui correspondra à la quantité de substrat disparu ou de produit apparu par unité de temps. Dans cet exemple, on a mesuré la vitesse au début d'une réaction (vitesse dite initiale) pour différentes concentrations de substrat. (la concentration en enzyme étant identique par ailleurs). |
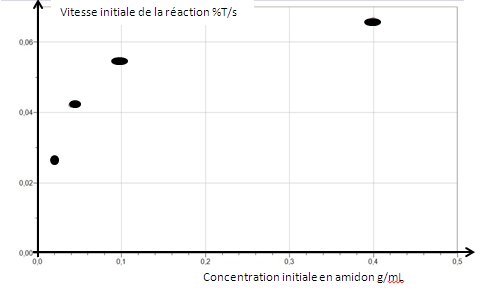 | Sur ce graphique, on étudie la vitesse d'hydrolyse de l'amidon en fonction de la concentration initiale en amidon. Vous remarquerez les unités: la vitesse est %T/s,
c'est-à-dire qu'on a mesuré en fait la vitesse de disparition de l'amidon par seconde. En abscisse, vous avez les concentrations initiales en amidon.
|
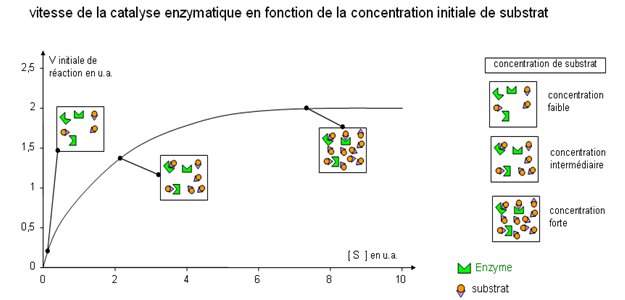 |
Observez bien le graphique ci-contre. Lorsque la concentration en substrat est faible, tous les sites actifs des enzymes ne sont pas occupés: les enzymes "mobilisés" vont catalyser la transformation du substrat mais peu de substrat sera transformé.
|
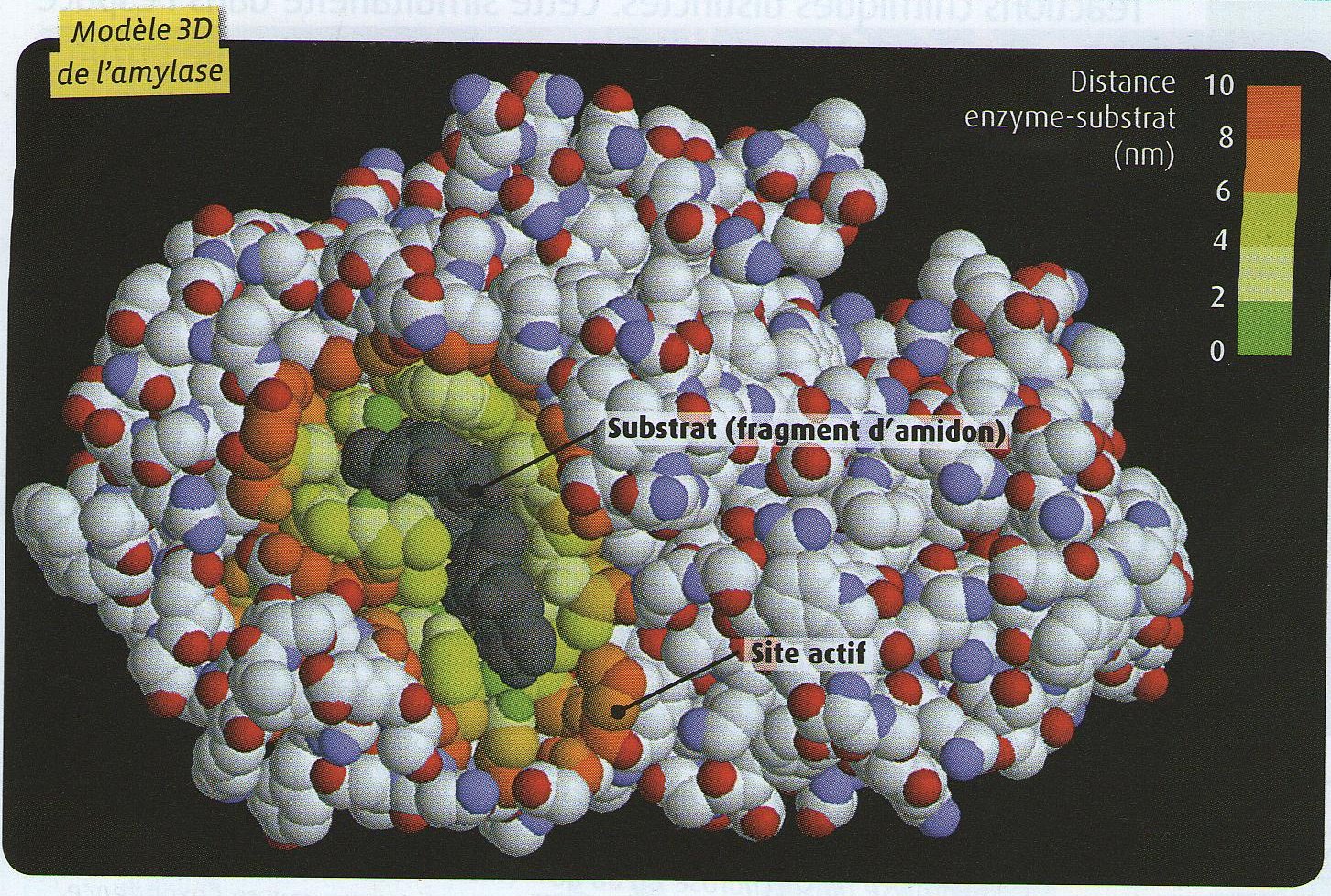 | Ci-contre, une modélisation du complexe amylase - amidon. Il faut que vous compreniez que, puisque les enzymes sont des protéines, leur synthèse est gouverné par des gènes.
Par conséquent, des mutations sur ces gènes peuvent modifier la séquences en acides aminés. Or, en modifiant cette séquence, c'est la structure secondaire qui peut
être affectée et donc la structure tertiaire. Vous comprenez que si le ou les changements d'acides aminés
qui participent à la forme du site actif, c'est l'activité de l'enzyme qui est alors modifiée:
pas de reconnaissance au substrat ou pas d'activité catalytique (site catalytique affecté) et donc pas
de réaction chimique.
|
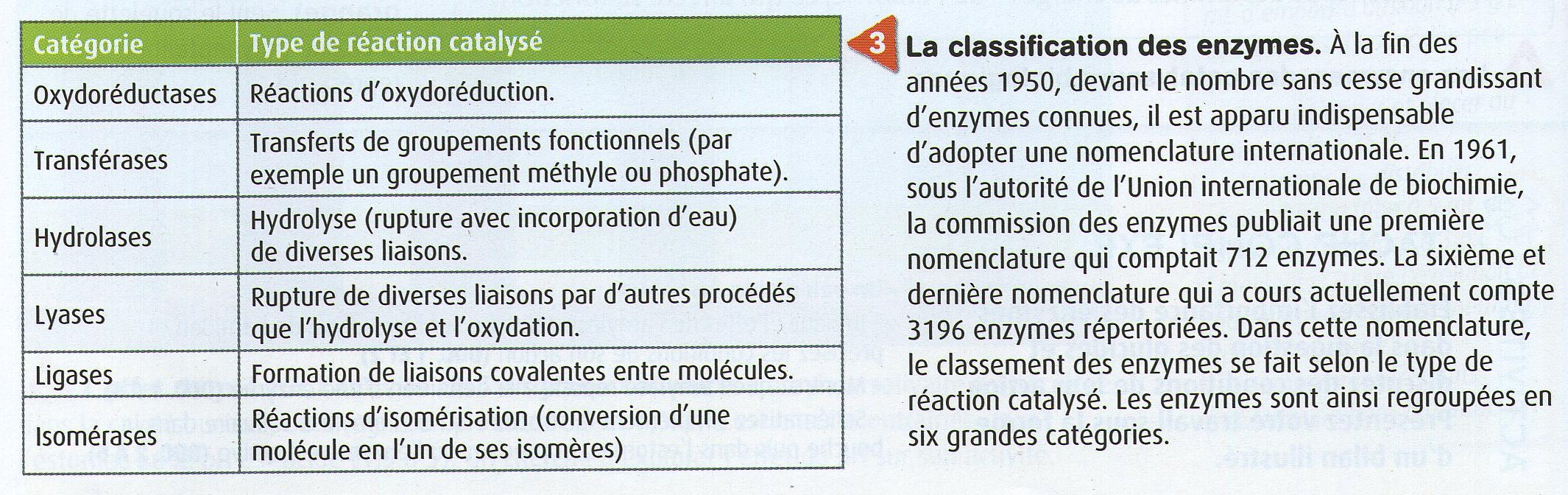 | Ci-contre, de nombreuses enzymes pour vous montrer les nombreux rôles (et encore ce document n'est pas complet!) |
Consignes: vous allez travailler en écriture collaborative à distance en utilisant les liens envoyés sur vos mails. Les documents dont vous aurez besoin (cliquez et téléchargez)
|
 |
 |
 |